Sobre o estudo comparativo
A análise de alto rendimento de pesticidas tem sido prejudicada pelo lento e trabalhoso estágio de preparação da amostra. Usando procedimentos de limpeza tradicionais, mais de vinte etapas são necessárias para obter a amostra em uma forma conveniente para análise, o que limita o rendimento da amostra a normalmente 8 amostras por dia. Esse estudo avalia uma nova abordagem usando um homogeneizador de tecido de laboratório inovador, para extrair vários resíduos de pesticidas de diferentes tipos de materiais vegetais e para identificar e quantificar os ingredientes ativos por LC / MS / MS. Isso mostra que, ao automatizar o procedimento de preparação da amostra, o número de etapas de limpeza pode ser reduzido significativamente, resultando em um maior rendimento da amostra em relação às abordagens tradicionais.
Discussão
Três dos principais pesticidas vendidos pela DuPont são Famoxate®, Curzate® e Ta nos® para combate a doenças fúngicas em plantações. Famoxate® é um fungicida que contém o ingrediente ativo famoxadona e é usado principalmente para controlar a requeima de tomates. Ele protege da germinação de esporos e do crescimento de fungos por sua forte adesão às superfícies das folhas e caule. Curzate é um fungicida que contém cimoxanil como ingrediente ativo e é usado principalmente para a requeima da batata, mas também é aplicado a uvas, tomates, pepinos e vegetais folhosos. Seu mecanismo de proteção é penetrar na superfície para induzir a resposta de defesa do hospedeiro, para impedir o crescimento e a esporulação da lesão. Ta nos é um fungicida que contém famoxadona e cimoxanil e o efeito cumulativo desses dois ingredientes ativos oferece um controle ainda melhor da requeima da batata. O resíduo de pesticida típico definido na DuPont contém 8 amostras e geralmente leva um dia de trabalho de 8 horas para ser concluído. O objetivo deste estudo foi aproveitar os desenvolvimentos recentes na preparação de amostras com o Geno / Grinder® e a sensibilidade e seletividade do instrumento usando o sistema API 5000 LC / MS / MS para aumentar o número de amostras analisadas por dia por um fator de três . A metodologia segue o Método de Teste Multirresíduo OPPTS 860-1360 (1), que foi desenvolvido pelo Escritório de Prevenção, Pesticidas e Substâncias Tóxicas (OPPTS) da Agência de Proteção Ambiental dos Estados Unidos (USEPA), para uso no teste de pesticidas e substâncias tóxicas sob este método.


Preparação
A preparação da amostra para a análise de resíduos de pesticidas geralmente segue o Relatório DuPont nº AMR 3705-95, método analítico para a determinação de resíduos de famoxadona e cimoxanif em várias matrizes ”. (2) Neste procedimento, as amostras moídas são pesadas em frascos de extração, seguidas pela adição de água para permitir que sejam reidratadas antes da extração. O acetonitrilo é adicionado e as amostras são trituradas com um homogeneizador de laboratório. A matriz vegetal é então assentada e os extratos líquidos são filtrados e coletados em cilindros de mistura contendo cloreto de sódio. Os cilindros de mistura são tampados, agitados e invertidos para auxiliar na dissolução do cloreto de sódio e, em seguida, deixados em repouso enquanto as fases de acetonitrila (camada superior) e água são separadas. Alíquotas de acetonitrila separadas são retiradas para análise de cimoxanil e famoxadona.
Análise de cimoxanil
Para a análise de cimoxanil, a alíquota de acetonitrila é extraída de volta com hexano, concentrada, diluída com água e passada através de um cartucho de extração de fase sólida (SPE) de troca aniônica forte condicionada (SAX) empilhado sobre um cartucho SPE de negro de fumo condicionado. O cimoxanil passa pelo cartucho SAX e é retido no cartucho negro de fumo. Em seguida, é eluído seletivamente do cartucho e os resíduos de cimoxanil concentrados são dissolvidos em uma mistura de hexano / acetato de etila. As soluções resultantes são passadas por cartuchos de sílica SPE. O cimoxanil é etanhado, eluído seletivamente e concentrado em uma mistura de metanol / água ajustada para pH 3. As amostras são filtradas e analisadas por HPLC com detecção de UV. Para a análise da farnoxadona, a alíquota de acetonitrila é extraída de volta com hexano, a fração de acetonitrila é concentrada a aproximadamente 2 ml e cuidadosamente levada à secura. O resíduo é dissolvido em 10% éter etílico / 90% hexano (v / v) e passado através de uma coluna de cromatografia de vidro cheia com uma camada de sulfato de sódio, Florisil e sulfato de sódio. Cada coluna é lavada com 10% de acetato de etilo / 90% hexano adicional (v / v). O eluato é concentrado, cuidadosamente levado à secura, reconstituído em acetonitrila e água e analisado por LC / UV.


Preparação de amostra para
As melhores condições para o processamento do manjericão fresco foram encontradas em 90 seg. a 2.000 ciclos / min com o 2.000 Geno / Grinder. Aumentando o tempo de processamento para 120 seg. não parecia oferecer qualquer benefício. Além disso, o uso do Geno / Grinder deu DNA de maior qualidade do que o obtido com o lisador competitivo. Otimização adicional do tempo de processamento pode ser possível, variando o tipo e tamanho do meio de moagem. No entanto, isso estava além do escopo deste projeto e não foi tentado. As condições ideais de lise para o 2010 Geno / Grinder redesenhado podem diferir um pouco daquelas relatadas aqui.
Geno
Para reduzir ainda mais as etapas de limpeza, uma nova peça de tecnologia foi avaliada, chamada de Geno / Grinder (SPEX SamplePrep, Metuchen, NJ). O Geno / Grinder é um moinho de laboratório e homogeneizador de tecido projetado especificamente para agitação vertical vigorosa de placas de titulação de poços profundos. Ele foi originalmente projetado para preparar o tecido vegetal para extrações de ácidos nucléicos, proteínas e outros constituintes agitando o tecido, bolas de aço e um agente tampão juntos em cada poço de uma placa de titulação. A aplicação desta ferramenta pode ser expandida para incluir microorganismos
Contas são usadas em vez de bolas de moagem de aço. Os micróbios também podem ser interrompidos em placas de titulação de 96 poços padrão, em oposição às placas de poços profundos. O material de amostra que pode ser preparado inclui bactérias, leveduras, bolores, sementes, caules, raízes, folhas e certos tecidos animais. Devido à força do movimento de agitação vertical do equipamento, muitas sementes e outras formas de tecido vegetal também podem ser pulverizadas a seco em placas com a ajuda de uma ou duas bolas de moagem por poço. Outro benefício dessa tecnologia é que a economia de tempo adicional é alcançada porque os frascos de amostra são descartáveis, o que significa que o laborioso processo de limpeza das sondas do homogeneizador é eliminado. O Geno / Grinder é mostrado na Figura 1.


Limpeza de amostra usando
Para reduzir ainda mais as etapas de limpeza, uma nova peça de tecnologia foi avaliada, chamada de Geno / Grinder (SPEX SamplePrep, Metuchen, NJ). O Geno / Grinder é um moinho de laboratório e homogeneizador de tecido projetado especificamente para agitação vertical vigorosa de placas de titulação de poços profundos. Ele foi originalmente projetado para preparar o tecido vegetal para extrações de ácidos nucléicos, proteínas e outros constituintes agitando o tecido, bolas de aço e um agente tampão juntos em cada poço de uma placa de titulação. A aplicação desta ferramenta pode ser expandida para incluir microorganismos
Para as folhas de culturas aquosas como tomate e batata, 10 g de amostra foram extraídos duas vezes com 20 ml de uma mistura 90/10 de solução de acetonitrila / água, usando troca aniônica forte (SAX) e o processo de extração em fase sólida (SPE) descrito mais cedo. Para garantir a extração completa dos compostos do material vegetal, bolas de aço foram adicionadas às amostras para pulverizar o material vegetal. As amostras foram então extraídas por agitação em altas velocidades em um Geno / Moedor a aproximadamente 700 -1200 ciclos por minuto, dependendo da amostra. O extrato da amostra foi levado a 50,0 ml pela adição de acetonitrila. Aproximadamente 1 ml do extrato foi filtrado e 100 µL da amostra diluídos para 1,0 ml em um frasco de HPLC com fase móvel, e analisados diretamente por LC / MS / MS. O uso do Geno / Grinder reduziu o número de etapas de limpeza para 3.
Experimental
Para reduzir ainda mais as etapas de limpeza, uma nova peça de tecnologia foi avaliada, chamada de Geno / Grinder (SPEX SamplePrep, Metuchen, NJ). O Geno / Grinder é um moinho de laboratório e homogeneizador de tecido projetado especificamente para agitação vertical vigorosa de placas de titulação de poços profundos. Ele foi originalmente projetado para preparar o tecido vegetal para extrações de ácidos nucléicos, proteínas e outros constituintes agitando o tecido, bolas de aço e um agente tampão juntos em cada poço de uma placa de titulação. A aplicação desta ferramenta pode ser expandida para incluir microorganismos
Para avaliar a eficiência da etapa de preparação e limpeza da amostra descrita acima, cimoxanil, o ingrediente ativo em muitos dos fungicidas e seus vários metabólitos, foram determinados em uma série de culturas / materiais vegetais secos e úmidos. Todas as amostras geradas foram analisadas usando API 5000 LC / MS / MS (Applied Biosystems, Foster City, CA). Este instrumento é acoplado a um sistema de HPLC para separar primeiro as espécies biológicas de interesse, com base em seus tempos de eluição em uma coluna. O eluente é então introduzido no espectrômetro de massa para ionização para identificar e quantificar as espécies usando a tecnologia MS triplo quadrupolo. O princípio desta tecnologia é baseado na confirmação de um íon molecular particular pela geração de sua espécie filha usando dissociação induzida por colisão ou fragmentação (4).


Para reduzir ainda mais as etapas de limpeza, uma nova peça de tecnologia foi avaliada, chamada de Geno / Grinder (SPEX SamplePrep, Metuchen, NJ). O Geno / Grinder é um moinho de laboratório e homogeneizador de tecido projetado especificamente para agitação vertical vigorosa de placas de titulação de poços profundos. Ele foi originalmente projetado para preparar o tecido vegetal para extrações de ácidos nucléicos, proteínas e outros constituintes agitando o tecido, bolas de aço e um agente tampão juntos em cada poço de uma placa de titulação. A aplicação desta ferramenta pode ser expandida para incluir microorganismos
Esta técnica, comumente conhecida como monitoramento de reação múltipla (MRM), usa dois filtros de massa quadrupolo de resolução, separados por outro quadrupolo, que é ligeiramente pressurizado pela introdução de um gás de colisão como hidrogênio ou hélio. No modo MS / MS, o primeiro quadrupolo é usado em um modo de resolução de massa para selecionar o íon precursor. O segundo quadrupolo (ou célula de colisão multipolo pressurizada) é usado para produzir a fragmentação do precursor ou íon parental. O quadrupolo final é usado em um modo de resolução de massa para fornecer análise de massa dos íons fragmentados ou filhos resultantes. Essas espécies são então comparadas a espectros / dados de referência para produzir uma identificação inequívoca das biomoléculas de interesse. O instrumento LC / MS / MS usado para este estudo é mostrado na Figura 2. Usa dois filtros de massa quadrupolo de resolução, separados por outro quadrupolo, que é ligeiramente pressurizado pela introdução de um gás de colisão como o hidrogênio ou o hélio. No modo MS / MS, o primeiro quadrupolo é usado em um modo de resolução de massa para selecionar o íon precursor. O segundo quadrupolo (ou célula de colisão multipolo pressurizada) é usado para produzir a fragmentação do precursor ou íon parental.
O quadrupolo final é usado em um modo de resolução de massa para fornecer análise de massa dos íons fragmentados ou filhos resultantes. Essas espécies são então comparadas a espectros / dados de referência para produzir uma identificação inequívoca das biomoléculas de interesse. O instrumento LC / MS / MS usado para este estudo é mostrado na Figura 2. Usa dois filtros de massa quadrupolo de resolução, separados por outro quadrupolo, que é ligeiramente pressurizado pela introdução de um gás de colisão como o hidrogênio ou o hélio. No modo MS / MS, o primeiro quadrupolo é usado em um modo de resolução de massa para selecionar o íon precursor. O segundo quadrupolo (ou célula de colisão multipolo pressurizada) é usado para produzir a fragmentação do precursor ou íon parental. O quadrupolo final é usado em um modo de resolução de massa para fornecer análise de massa dos íons fragmentados ou filhos resultantes. Essas espécies são então comparadas a espectros / dados de referência para produzir uma identificação inequívoca das biomoléculas de interesse.


O instrumento LC / MS / MS usado para este estudo é mostrado na Figura 2, que é ligeiramente pressurizado pela introdução de um gás de colisão como o hidrogênio ou o hélio. No modo MS / MS, o primeiro quadrupolo é usado em um modo de resolução de massa para selecionar o íon precursor. O segundo quadrupolo (ou célula de colisão multipolo pressurizada) é usado para produzir a fragmentação do precursor ou íon parental. O quadrupolo final é usado em um modo de resolução de massa para fornecer análise de massa dos íons fragmentados ou filhos resultantes. Essas espécies são então comparadas a espectros / dados de referência para produzir uma identificação inequívoca das biomoléculas de interesse. O instrumento LC / MS / MS usado para este estudo é mostrado na Figura 2, que é ligeiramente pressurizado pela introdução de um gás de colisão como o hidrogênio ou o hélio. No modo MS / MS, o primeiro quadrupolo é usado em um modo de resolução de massa para selecionar o íon precursor. O segundo quadrupolo (ou célula de colisão multipolo pressurizada) é usado para produzir a fragmentação do precursor ou íon parental. O quadrupolo final é usado em um modo de resolução de massa para fornecer análise de massa dos íons fragmentados ou filhos resultantes. Essas espécies são então comparadas a espectros / dados de referência para produzir uma identificação inequívoca das biomoléculas de interesse.
O instrumento LC / MS / MS usado para este estudo é mostrado na Figura 2. O segundo quadrupolo (ou célula de colisão multipolo pressurizada) é usado para produzir a fragmentação do precursor ou íon parental. O quadrupolo final é usado em um modo de resolução de massa para fornecer análise de massa dos íons fragmentados ou filhos resultantes. Essas espécies são então comparadas a espectros / dados de referência para produzir uma identificação inequívoca das biomoléculas de interesse. O instrumento LC / MS / MS usado para este estudo é mostrado na Figura 2. O segundo quadrupolo (ou célula de colisão multipolo pressurizada) é usado para produzir a fragmentação do precursor ou íon parental. O quadrupolo final é usado em um modo de resolução de massa para fornecer análise de massa dos íons fragmentados ou filhos resultantes. Essas espécies são então comparadas a espectros / dados de referência para produzir uma identificação inequívoca das biomoléculas de interesse. O instrumento LC / MS / MS usado para este estudo é mostrado na Figura 2.


Os benefícios do projeto MS / MS é que ele também pode ser usado no modo MS para fins de quantificação. Neste modo, o primeiro quadrupolo é normalmente usado no modo somente rf, como ampla faixa de massa. A célula de colisão também é usada no modo rf, mas desta vez o gás de colisão está fluindo, então a célula é usada apenas para transmitir íons para o último quadrupolo, que é usado no modo de resolução maas. A capacidade de alternar entre os dois modos é muito importante, a fim de maximizar a quantidade de dados que está sendo gerada, especialmente quando uma pequena quantidade de amostra está sendo analisada. Não há dúvida de que quanto maior for a eliminação dos íons fragmentados que forem identificados, melhor será a confirmação das moléculas parentais. Isso é especialmente importante ao analisar dados de uma separação LC. Cimoxanil, por exemplo, que é um composto de nitrogênio alfatico com uma fórmula de C7H10N4O3 e peso molecular de 198, normalmente elui da coluna após 10 a 15 minutos, ao longo do período de 20 – 30 segundos. Por este motivo, é muito importante ser capaz de alternar rapidamente entre o modo SIM e o modo MRM, para coletar tanto a informação molecular quanto a fragmentada, para a ideficiação positiva e inequívoca da espécie. Uma vez que a identificação é feita no modo MRM, a quantificação de amostras desconhecidas é normalmente realizada no modo SIM.
Metodologia de
A carmoatografia líquida de fase reversa foi usada para separar o cymxanil e ele se metaboliza do resto dos extratores. O instrumento LC / MS / MS foi operado no modo de monitoramento de íon único MS de íons negativos para análises quantitativas. A área do pico foi usada para quantificação. Para confirmação da presença do analito em amostras desconhecidas, as intensidades relativas dos íons fragmentados foram medidas usando o modo MRM. Um breve resumo das condições de HPLC e LC / MS / MS é mostrado na Tabela 1.

Uma amostra de fortificação LOQ de 0,01 ppm de cimoxanil (DuPont-13753) e controle (em branco) no modo SIM é mostrado na Figura 3. Pode ser visto muito claramente que há um pico significativo eluído em cerca de 15 minutos, o que corresponde ao cimoxanil. A confirmação do composto é então feita medindo as intensidades dos íons filhos fragmentados no modo MS / MS, comparando-os a proporções conhecidas em um banco de dados de pesticidas. O espectro de MS / MS (60-300 Daltons) de cimoxanil no modo MRM é mostrado na Figura 4, enquanto a curva de calibração resultante para 0,2, 0,5, I .0, 5,0 e 10,0 ug / L é mostrada na Figura 5.

Figura 3. Eluição de cimoxanil usando o modo LC / MS

Figura 4. O MRM o espectro de cimoxanil mostrando os íons fragmentados

Figura 5. Curva de calibração para 0,2, 0,5, 1,0, SD e 100μg / L de cimaxanil

Resultados
A separação LC / MS do novo inseticida experimental sob investigação e seus metabólitos (AG) são mostrados na Figura 6. O MRM (1-298 Daltons) de um padrão de 0,2 ppm dos metabólitos D e E junto com uma amostra de tomate adicionada de o LOQ é mostrado na Figura 7. A Tabela 3 compara a preparação de Geno / Moedor e o método de limpeza com uma preparação de amostra de homogeneizador tradicional (sonda Tissuemizer®) usando a metodologia Dupont-13753 descrita anteriormente. Mostra dados quantitativos (ppm na amostra) para o novo composto experimental e um de seus metabólitos (D), para várias amostras de cultura.
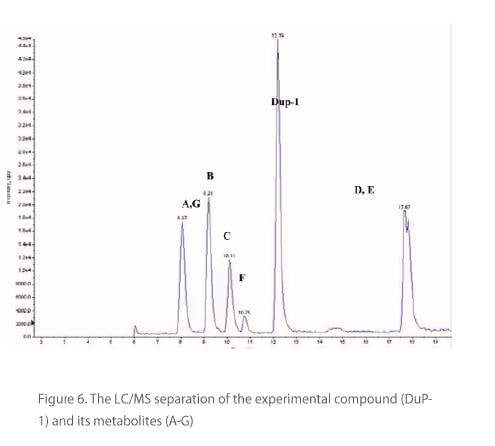
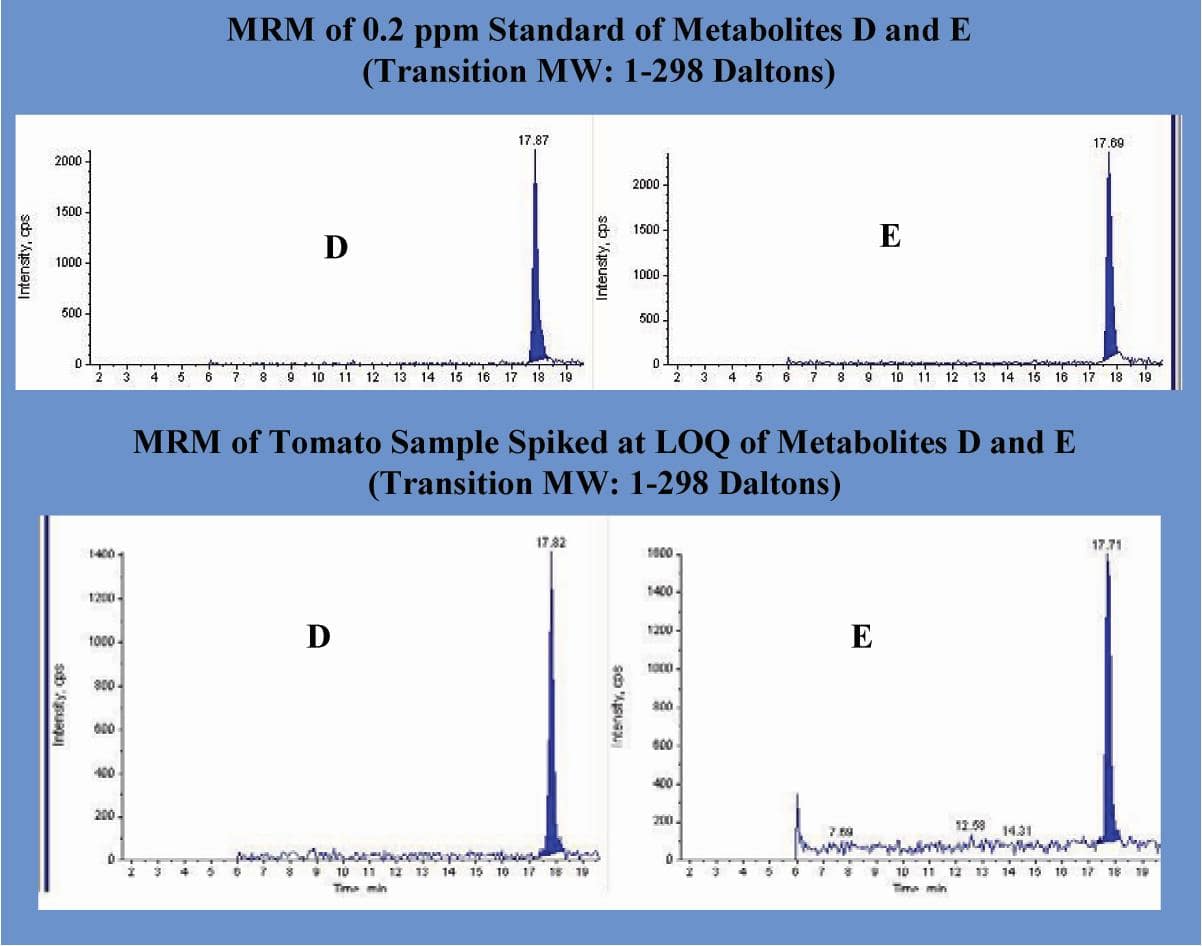
Figura 7. O MRM de um padrão de 0,2 ppm dos metabólitos D e E (parte superior) junto com uma amostra de tomate adicionada no LOQ (parte inferior). A transição é mostrada com um peso molecular de 1-298 \ Daltons.
Essa metodologia foi então usada para analisar uma variedade de colheitas úmidas, secas, oleosas e ácidas para o ingrediente ativo junto com seus metabólitos. A Tabela 4 mostra a recuperação do pico e os dados RSD para uma das culturas aquosas (tomate), mostrando que DuP-1 e todos os seus metabólitos estão dentro das diretrizes estabelecidas no Método de Teste Multirresíduos EPA OPP TS 860-1360 para testes de pesticidas e substâncias tóxicas, que afirma que os dados de teste devem ter recuperações médias entre 70-120% com uma precisão de menos de 15% RSD. Embora não sejam apresentados aqui, o estudo também analisou outras culturas, incluindo lima (cultura ácida), amêndoas (cultura oleosa) e palha de trigo (cultura seca) e obteve recuperações de espigas e valores de precisão semelhantes.
Conclusōes
Foi demonstrado que a extração de resíduos de pesticidas com o Geno / Grinder e a identificação e quantificação de seus ingredientes ativos e metabólitos usando LC / MS / MS, fornece um método analítico extremamente eficiente, robusto e de alto rendimento. Em comparação com os métodos tradicionais de preparação, limpeza e detecção de amostras, o rendimento da amostra aumentou em um fator de 3, de 8 para 24 amostras por dia.

Tire suas dúvidas ou
Solicite sua cotação aqui






